
執筆:弁護士 宮田 智昭 、弁護士 吉岡 拓磨(メディカル・ビューティー・ヘルスケアチーム)
1.はじめに
プログラム医療機器(=Software as a Medical Device:SaMD)とは、①疾病の診断、治療、予防に寄与するなど、医療機器としての目的性を有しており、かつ、②意図したとおりに機能しない場合に患者(又は使用者)の生命及び健康に影響を与えるおそれがあるプログラム(ソフトウェア機能)をいいます。プログラム医療機器の承認件数は年々増加しており、令和2年11月24日に、厚生労働省から、「プログラム等の最先端医療機器の審査抜本改革(DASH for SaMD)」が公表されたことは注目を集めました。
このようなプログラム医療機器が注目を集めている状況において、本連載では、プログラム医療機器の現状とその法規制について解説していきます。
2.国内の承認状況と海外との比較
高齢化が進んでいる我が国において、医療の需要が拡大している中、効率的・効果的な医療が求められており、遠隔モニタリング等を通じて医療を個別化・最適化することができるデジタル技術の活用が重要となってきています。2022年1月末のデータによると、以下の表のとおり、その承認件数は毎年増加傾向であり、累計169件(2022年1月末時点)となっています。
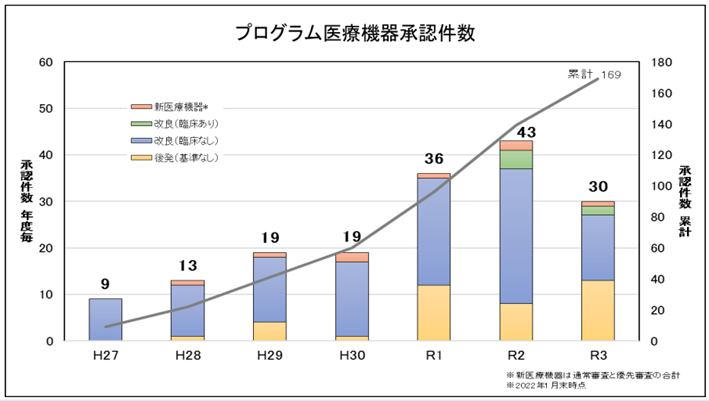
(PMDA「医療機器にかかるPMDAの取組」より抜粋)
ただ、海外と比べて承認件数はまだまだ多くありません。その主な原因として、販売するまでのフェーズごとに以下の理由があると考えられています。
【開発段階】
医療機器に該当するか否かの判断基準が明確でなく、薬機法の規制対象になるか否かの判断が難しい。
投資費用が回収できるか不透明で、ビジネスモデル・マネタイズ戦略が立てにくい。
個人情報の取り扱いのハードルが高く、時間的・経済的コストがかかる。
【薬事承認段階】
承認審査に時間がかかる。
審査要件や評価指標が不透明である。
【上市段階】
現行の医療保険制度においては、医療の質の向上や業務の効率化といったSaMD特有の性質が評価されにくい。
一方、ドイツやアメリカでは、デジタル分野の特性を考慮して、安全性と一定の有効性をもとに承認・保険償還することで上市を加速しながら、上市後に実臨床データで有効性を検証・評価することを意図した制度が施行されています。
このような状況のもとで、厚労省は、医療機器プログラムへの該当性判断に係る明確化・精緻化のために、「プログラムの医療機器該当性に関するガイドラインについて」(令和3年3月31日付け薬生機審発0331第1号・薬生監麻発0331第15号)やプログラム医療機器事例データベースを公表しています。また、後述するようにDASH for SaMD(厚生労働省)やIDATENといった新たな取り組みを始めています。
また、プログラム医療機器は、疫病の診断、治療、予防、緩和などを目的にしたものですが、プログラム医療機器の中でも医学的なエビデンスに基づき、治療介入を提供するものは、デジタルセラピューティクス(Digital Therapeutics:DTx)と呼ばれています。世界初のDTxは、2010年に米国食品医薬品局(FDA)から医療機器として薬事承認を受けた糖尿病患者の治療アプリ「BlueStar」(WellDoc社)であり、米国やドイツではその後も様々なDTxが承認されています。その一方、わが国では2020年にはじめて株式会社CureAppが開発した「ニコチン依存症治療アプリ」が薬事承認されたという状況であり、DTxの承認状況については海外と比べて後れを取っています。
3.CureAppの事例
(1)ニコチン依存症治療アプリ
日本で初めて医療機器として承認されたのは、株式会社CureAppが開発した「CureApp SC ニコチン依存症治療アプリ及びCOチェッカー」です。この製品は、スマートフォンにダウンロードして使用するアプリと、息の中の一酸化炭素濃度を測って喫煙状況をモニタリングする機械(COチェッカー)を組み合わせたものです。
患者がアプリに入力する日々の経過や状態などをもとに、アルゴリズムが個々人の状態を解析し、その方の特徴や状況に合わせて医学的に適切な治療介入を行います。国内におけるニコチン依存症患者を対象として、有効性と安全性についての臨床試験(治験)が実施されており、医学的なエビデンスを有しています。
(2)高血圧治療アプリ
2022年年4月、株式会社CureAppが開発した本態性高血圧症に対する治療用アプリ「CureApp HT」が国内で初めてソフトウェア単体での薬事承認を受けました。「CureApp HT」は、ソフトウェア単体の治療アプリであり、患者ごとに個別化された「治療ガイダンス」を患者に提供します。患者は医療機関での受診日から次の受診日まで、日々自宅で治療経過、体調などをアプリに記録し、記録したデータに基づいて、アプリが適切な行動変容に関する指導・ガイダンスを患者に提供します。国内における臨床試験では、CureApp HTを使うことで有意な降圧効果が認められています。
4.厚労省の取り組み
(1)DASH for SaMD
厚生労働省は、令和2年11月24日に「プログラム医療機器実用化促進パッケージ戦略(DASH for SaMD:DX(Digital Transformation) Action Strategies in Healthcare for SaMD(Software as a Medical Device))」を公表しました。
上述したSaMDの承認に関する課題について、プログラム医療機器の実用化を促進するため、以下の4つの戦略を打ち出しています。
① 萌芽的シーズの早期把握と審査の考え方の公表
② 相談窓口の一元化
③ プログラム医療機器の特性を踏まえた審査制度
④ 早期実用化のための体制強化等

(厚生労働省医薬・生活衛生局「プログラム等の最先端医療機器の審査抜本改革」から抜粋)
また、DASH for SaMDに基づき、令和3年4月1日には、厚労省にプログラム医療機器審査管理室、プログラム医療機器調査会、PMDA(独立行政法人医薬品医療機器総合機構)にPMDAプログラム医療機器審査室と一元的相談窓口が設置されました。
(2)IDATEN
IDATEN(Improvement Design within Approval for Timely Evaluation and Notice)とは、医療機器の特性に応じた変更計画の事前確認制度の通称であり、令和2年8月31日に導入された制度になります。
SaMDは従来の医療機器と比較してバージョンアップが非常に高頻度に行われます。例えば、AIを用いた医療機器プログラムは、学習データを頻繁に更新することで精度が上がり、性能向上が見込めます。もっとも、これまで性能に関する変更を行う際は、その都度「一部変更承認申請」を行う必要があり、製造販売業者にとって、数ヶ月の審査期間と手数料が負担となっていました。このような負担を軽減するためにIDATENが導入されました。承認後すぐに改善・改良が見込まれているSaMDについて、変更計画自体を審査の過程で確認し、その計画の範囲内であれば「製造販売承認事項軽微変更届出」を行うだけで改良を認めるため、審査期間や手数料等の費用を大幅に縮減出来ることによって、より迅速に、高性能な医療機器を提供することが可能となります。
5.まとめ
本稿においては、プログラム医療機器(SaMD)の現状と今後についてまとめました。我が国におけるSaMDを取り巻く状況は、海外に比べて遅れているのが現状です。もっとも、SaMDの需要は高く、厚労省も様々な取り組みを進めて、安全にSaMDが利用される社会を創出しようとしている段階になります。次回以降、SaMDに関する法規制について解説しますが、GVA法律事務所は、法的観点からSaMDの開発を支援しており、SaMDの日本における動向に注目しています。
監修
弁護士 早崎 智久
(スタートアップの創業時からIPO以降までの全般のサポート、大手企業の新規事業のアドバイスまでの幅広い分野で、これまでに多数の対応経験。 特に、GVA法律事務所において、医療・美容・ヘルスケアチームのリーダーとして、レギュレーションを踏まえた新規ビジネスのデザイン、景表法・薬機法・健康増進法などの各種広告規制への対応、医療情報に関する体制の整備などが専門。)











