執筆:弁護士 早崎 智久(メディカル・ビューティー・ヘルスケアチーム)
連載:薬機法とは ~薬機法の基本~
※過去のものはこちらです
『第1回 薬機法の全体像』はこちらから
『第2回 「医薬品等」とは』はこちらから
『第3回 医薬品の販売と薬局 ① -医薬品の種類-』はこちらから
『第4回 医薬品の販売と薬局② -医薬品の販売と薬局-』はこちらから
『第5回 医薬品の製造販売① -全体像と製造販売業・製造業・製造管理-』はこちらから
『第6回 医薬品の製造販売② -医薬品の製造販売承認-』はこちらから
『第7回 製造販売後の医薬品 -医薬品の安全管理と有効性の再確認-』はこちらから
1.はじめに
GVA法律事務所では、メディカル、美容、ヘルスケア領域に関して専門チームを設け、各分野について多様なサポートをさせていただいております。
本連載では薬機法の基本について解説しておりますが、今回は医薬品に関する最後の回として、医薬品の情報を消費者に対して伝える場面を扱います。具体的には、「医薬品の包装等への表示」、「添付文書」、「広告」の3つについてご説明いたします。
なお、「医薬品の表示」は、一般的に医薬品の販売に関する項目として説明されることが多いのですが、医薬品の表示は、医薬品に関する重要な情報を消費者に明示するものです。そのため、これまで見てきた医薬品に関する販売、製造販売、安全管理などの他の事項を先に理解したほうが、表示に関する理解が分かりやすいと思いますので、最後の回にしています。
2.医薬品の情報を消費者に伝える場面での規制の概要
まず、これまでも、医薬品には、安全性・有効性・品質のどこにも問題がないことが大切だという視点を、繰り返しご説明してきました。その理由は、医薬品は人の身体に使うもので、他のモノと比べても、人体への影響が大きいためです。そして、その影響を受けるのは、医薬品を製造したり販売したりする人ではなく、医薬品を実際に使う患者や消費者です。
そのため、その医薬品がどんなもので、どんな効き目があるのか、どんな副作用があるのか、いつ作られたものなのか、といった情報は、実際に使用する人たちに正確に伝えることが必要になります、
つまり、今回ご説明する事項は、いずれも使用する人に医薬品の情報を正確に伝えるためのルールですが、その視点は、これまでと全く同じなのです。
以下では、「情報の内容や伝え方」に着目しながら、「使用する人にとって、安全性などとの関係でどんな意味があるんだろう?」と想像しながら見ていくのがよいと思います。
① 医薬品の直接の容器・被包の表示
1番目は、医薬品の容器や被包への情報の表示に関してです。
もし、患者などの医薬品を使用する人が、間違った使い方をしたり、別の医薬品を服用してしまったら問題が起きるのは誰にでも分かると思います。そのため、そのようなことがないようにするためには、使用する直前に、大切な情報を使用する人に伝える必要があります。
ただし、医薬品自体は錠剤や液状などであり、そのような医薬品自体に情報を記載することはできません。そのため、医薬品が入っている容器、被包などに、医薬品に関する重要な情報を表示することが義務付けられています。
② 医薬品の添付文書
2番目は、いわゆる添付文書です。
医薬品を購入したことがある人なら、医薬品のパッケージの中には、折られた状態の「説明書」が入っていることをどなたでも知っていると思います。これが「添付文書」と呼ばれるもので、医薬品に関する情報がぎっしりと記載されています。処方する医師らや使う人に対して、正確な情報を十分に伝えるためのものとして、重要なものになります。
医薬品は医療用医薬品、一般用医薬品に分かれていますが、それぞれ添付文書に記載する事項や表示の仕方は異なっています。また、令和3年の薬機法改正により、医療用医薬品についての電子化が行われましたので、従来と対応が変わったことも重要なポイントになります。
③ 医薬品の広告
3番目は医薬品の広告です。
多くの人は、広告から医薬品の情報を認識します。広告は、医薬品メーカーなどが、自社の医薬品を多くの人に知ってもらい、購入してもらうために行いますが、表示や添付文書と比べれば伝えられる情報量も少ないのが普通ですし、自社製品の良さをアピールするものであるため、副作用などは伝えたくないと思うのも普通です。そのため、消費者に誤解を招く、つまり、誤った情報を伝えてしまうリスクがあります。
以下では、この3つの事項について、順番にご説明していきます。
3.医薬品の直接の容器・包装などの表示
⑴ 医薬品の表示の概要
先ほども少し説明しましたが、改めて、薬機法が医薬品の直接の容器や包装への表示を求めている理由を確認しましょう。
皆さんが、遊園地に出かけてジェットコースターに乗ろうとすると、入口あたりに「心臓に疾患のある方は乗車をお控えください」といった注意書きが書いてあるのを見かけると思います。医薬品の表示は、これと同じようなものだと考えればわかりやすいと思います。
医薬品は、特定の疾患のためのものですし、副作用もあります。使い方にも気を付ける必要があります。そのため、心臓に疾患のある方がジェットコースターに乗らないように、医薬品を使う場合にも注意が必要になります。
医薬品の表示をする場所は「直接の容器や包装」とされていますが、これは、ジェットコースターであれば、まさに入口になるところです。条文では「直接の…」と書いてありますが、これは使う人が使う直前に目に触れる場所という意味なのです。使用する前に、特に伝えないといけない情報の伝達を法律が求めているということで、この視点で表示事項を見ていくと、理解しやすいと思います。
⑵ 表示をする場所
まず、どこに情報を表示するかを確認しましょう。
先ほどもご説明したように、薬機法では「直接の容器又は直接の被包」と書いてあります。これは、医薬品を直接入れてある容器、被包という意味です。これに関しては、「医薬品が入っている箱」だと勘違いする方がいますが、医薬品の箱(外箱)は「直接」のものではありませんので、これには当たりません。
こう言うと、「外箱にもいろいろ書いてあるじゃないか」と思われる方が大勢いらっしゃると思いますが、これは別のルールによるものです(外箱の表示に関しては添付文書に関するところで後述します)。
ひとまず、ここでは「外箱に書いてあるものは直接の容器への表示とは別物」ということだけを確認しておいてください。
⑶ 直接の容器・被包への表示事項
では、肝心の、どんな情報を表示しないといけないのかを見ていきましょう。
まず、医薬品の表示に関しては、薬機法やその規則などで、表示しなければいけない事項がはっきりと決められています。これは、たくさん書いてあってもきりがないですし、重要なところが抜けてしまったり、ぼやけてしまうリスクもあるためです。
具体的には、まず、薬機法の第50条が「医薬品は、その直接の容器又は直接の被包に、次に掲げる事項が記載されていなければならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。」としており、「次に掲げる事項」として、第1号から第15号までの計15個の事項が列記されています。
もっとも、この第15号は「前各号に掲げるもののほか、厚生労働省令で定める事項」としていますので、さらに「厚生労働省令」=薬機法施行規則の第210条では、第1号から第7号までの計7個の事項が列記されています。
次に、薬機法の第52条第1項は、主に医療用医薬品に関して、注意事項等の情報を入手するために必要な番号、記号その他の符号の記載も求めており、同条第52条第2項は、主に市販薬について、直接の容器・被包か添付文書に記載すべき事項を定めています。
(なお、第52条は、添付文書に関する条文でもあるので、後で丁寧に説明します。)
加えて、毒物と劇薬に関しては、薬機法第44条が表示事項を定めています。
このように、医薬品の表示事項は薬機法や施行規則に明確に定められていますので、表示するかどうかで悩むことはありませんが、条文も1つではなく、表示事項の数もかなり多くなっています。
ただし、内容ごとに整理をすることで、とても明確になります。
※ 注意点
・第2回でご説明したように、医薬品には「日本薬局方」という医薬品の規格の基準があります。医薬品に関する基礎情報とも言えるものなので、表示に関しても、これと連動する項目が多く設けられています。このような医薬品を「局方品」といいます。
・また、以下では、
薬機法第50条1号~14号の表示事項を①~⑭
薬機法第50条15号を受けた7つの事項をⅰ~ⅶ
52条の表示事項は【52】
44条の表示事項は【44】としています。
まず、表示事項を一覧にすると以下のとおりです。
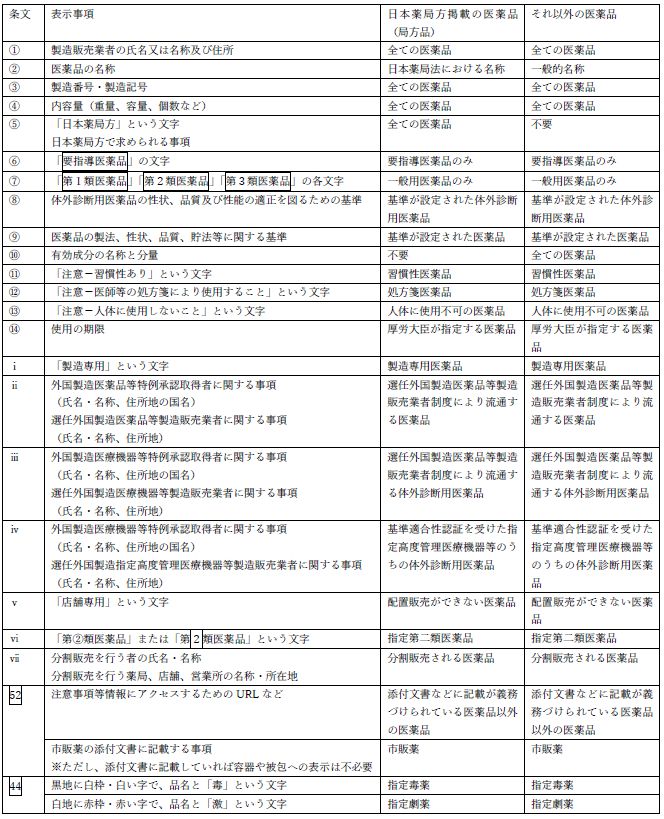
このように一覧で見るとかなり多いので、これをA~Eの5つのブロックに分類して整理しました。
ここでは、必ず表示するものをA、局方品か市販薬についてはB、特別な注意が必要な医薬品の表示事項がC、外国業者の特例の場合がD、その他をEとしています。
A 必ず表示が必要なもの
まず、基本的に表示することが求められる事項を見ると、以下のようになります。
① 製造販売業者の氏名又は名称及び住所
※これは、製造販売業者が、医薬品に関する主な責任者になりますので、使う人に分かるように、必ず表示することが必要になります。
② 医薬品の名称
※名称は医薬品を区別するものなので、当然に必要になります。
③ 製造番号・製造記号
※これは、同じ医薬品は多く生産されるため、いつの時点で製造されたものかを明確にするためです。
④ 内容量(重量、容量、個数など)
※どの程度の量なのかは、使う人にとって非常に重要な情報です。
⑩ 有効成分の名称と分量
※有効成分の名称や量も、内容量と併せて重要な情報になります。なお、注意すべき点としては、日本薬局方に記載のある医薬品(局方品)には表示義務はありません。これは日本薬局法を見れば分かるように、有効成分がそのまま記載されているためです。
B 医薬品の種類に関する事項
次は、医薬品の種類を明確にさせるための事項です。医薬品の種類に応じて表示することになります。局方品、一般用医薬品に関する事項です。
・日本薬局方に関する事項
→ ⑤ 「日本薬局方」という文字、日本薬局方で求められる事項
※日本薬局方では、有効成分の名称などがそのまま記載されているため、消費者において参照できるようにするための記載です。
・市販薬の区別に関する事項
要指導医薬品
→ ⑥ 「要指導医薬品」の文字
一般用医薬品
→ ⑦ 「第1類医薬品」「第2類医薬品」「第3類医薬品」の各文字
ⅵ 「第②類医薬品」または「第2類医薬品」という文字
C 特別な医薬品に関する事項
次のカテゴリは、特別な医薬品に関するものです。これらは、使用に際して特別な注意や配慮が必要になりますので、まさに使用の時点で注意喚起し、確認させるために、表示事項とされています。
・厚生労働大臣による基準が設定された医薬品に関する事項
→ ⑧ 体外診断用医薬品の性状、品質及び性能の適正を図るための基準
⑨ 医薬品の製法、性状、品質、貯法等に関する基準
※これらは、薬機法の規定により、厚生労働大臣が一定の基準を設定した医薬品に関する事項です。注意が必要なため、表示が必要とされます。
・習慣性医薬品
→ ⑪ 「注意-習慣性あり」という文字
※習慣性医薬品とは、睡眠薬や精神安定剤などの依存性がある医薬品です。一般用医薬品であっても使用に注意が必要な医薬品のため、注意喚起として表示が求められています。
・処方箋医薬品
→ ⑫ 「注意-医師等の処方箋により使用すること」という文字
※処方箋医薬品は医療用医薬品ですが、使用者が自由に選んで購入することができません。医師の指導の下での服用が必要になるため、注意喚起が必要になります。
・人体使用不可の医薬品
→ ⑬ 「注意-人体に使用しないこと」という文字
※これは、ネズミなどの動物の除去に使用される医薬品であり、人体への使用を想定していないため、注意喚起が必要になります。
・保管に注意が必要な医薬品
→ ⑭ 使用の期限
※適切な保存条件の下で製造後3年を超えて性状及び品質が安定であることが確認されている医薬品に関しては表示は不要ですが、そうではない医薬品については、使用の期限の表示が義務付けられてます。
・製造専用医薬品
→ ⅰ 「製造専用」という文字
※製造専用医薬品というのは、医薬品を製造するために使用される医薬品であり、一般人への販売は想定されていません。そのため、誤って服用しないように注意喚起が必要になります。
・店舗専用医薬品
→ ⅴ 「店舗専用」という文字
※店舗専用医薬品は、医薬品の販売業の一つである配置販売業では取り扱えない医薬品であることを表示するものです。
・毒薬・劇薬
→ 44 毒薬:黒地に白枠・白い字で、品名と「毒」という文字
劇薬:白地に赤枠・赤い字で、品名と「激」という文字
D 選任外国製造医薬品等製造販売業者制度
4つ目のカテゴリは、外国の業者に関するものです。
この連載の第6回において、外国の医薬品の製造販売に関して「選任外国製造医薬品等製造販売業者制度」をご説明しました。簡単に言えば、外国のメーカーが日本の企業と提携することで、特例として承認を受けて医薬品を流通させることができる制度です。
この場合は、通常の責任者(製造販売業者)とは変わってきますので、消費者に対してそのことを伝える必要があります。
表示事項の
ⅱ 外国製造医薬品等特例承認取得者に関する事項(氏名・名称、住所地の国名)
選任外国製造医薬品等製造販売業者に関する事項(氏名・名称、住所地)
ⅲ 外国製造医療機器等特例承認取得者に関する事項(氏名・名称、住所地の国名)
選任外国製造医療機器等製造販売業者に関する事項(氏名・名称、住所地)
ⅳ 外国製造医療機器等特例承認取得者に関する事項(氏名・名称、住所地の国名)
選任外国製造指定高度管理医療機器等製造販売業者に関する事項(氏名・名称、住所地)
は、この場合にのみ必要になる事項です。
E その他
最後は、その他の特殊な場合に表示が必要になる事項です。
・分割販売をする場合
→ ⅶ 分割販売を行う者の氏名・名称
分割販売を行う薬局、店舗、営業所の名称・所在地
※医薬品を分割販売する場合には、同じ者から購入することが想定されますので、これを明示するものです。
・添付文書に関連する事項
→ 52 医療用医薬品:注意事項等情報にアクセスするためのURLなど
市販薬 :市販薬の添付文書に記載する事項
※医療用医薬品に関しては、使用者が添付文書などにアクセスできるようにURLなどの符号を表示するものとされています。
市販薬の場合は、添付文書に記載する事項を記載するものとされていますが、スペースの問題により実際に直接の容器や被包へ表示することは難しいので、添付文書に記載していれば直接の容器や被包への表示は必要ないとされています。
以上のように、表示事項を分類してみれば、それほど複雑なものではないことがお分かりになるかと思います。一般的には、A+Bのパターンが多いと思われますが、CやEに該当するかどうかを検討すれば、おおよその表示事項は分かると思います。Dは外国の業者に限られます。
⑷ 表示方法と記載禁止事項
最後に、表示の仕方に関するルールと記載が禁止される事項をご説明します。
① 表示の方法
薬機法の第53条、薬機法施行規則の第217条で定められていることを整理すると、表示の方法は以下のとおりにする必要があります。
・他の文字、記事、図画又は図案に比較して見やすい場所に表示する
・明瞭に、日本語で正確に記載するいずれも医薬品の表示が求められる趣旨からは当然のことですが、要は、医薬品を購入して使用する人に、表示事項がきちんと伝わるようにするということです。
② 記載が禁止される事項
次に、薬機法の第54条では、以下の事項の表示を禁止しています。
・虚偽又は誤解を招くおそれのある事項
・医薬品の承認外の効能、効果又は性能
・保健衛生上危険がある用法、用量又は使用期間これらも、医薬品の性質からは当然のことばかりですが、医薬品の表示は、使用する人にもっともメッセージを伝えやすいものであることから、法律も、特に注意が必要と考え、禁止事項にしています。
4.医薬品の添付文書
⑴ 添付文書の概要
上記で確認した「医薬品の表示」は、医薬品の容器や包装に特に記載する事項でしたが、この「添付文書」は、医薬品の外箱などの中に、医薬品と一緒に入れておくものです。
表示事項が、特に伝えるべき事項を限定して表示することに対し、添付文書は、医薬品の取扱説明書として、より詳細な内容になっています。
ところで、添付文書については、最近、とても大きなルール変更がありましたので、まずはこれを確認しましょう。
添付文書の記載事項は、かつては文字通りに「文書」に記載するものとされていました。しかし、令和3年(2021年)の薬機法改正により、医療用医薬品の添付文書は原則として電子化され、一方で、市販薬は紙の文書のままという形になりました。これは社会のデジタル化に合わせたものでもありますが、一方で一般の消費者を対象にする市販薬に関しては、使用する時点での確認が必要になるということから、紙媒体を継続することになりました。
この改正により、かつての薬機法第52条があらゆる医薬品を対象にしたもの(現在の第2項と同様の内容)であったことから大きく変わりました。改正後の第52条は、第1項で医療用医薬品を定め、第2項で市販薬を定めており、この違いに応じて、取扱いも分けています。
(なお、改正に伴い、条文のタイトルから「添付文書」という記載がなくなり、第1項には「添付文書」という用語の記載がありませんが、この条文が「添付文書」に関するものであることは従来と同様です。)
このように、医療用医薬品と市販薬では性質が違いますので、添付文書についても、医療用医薬品と市販薬とで分けて理解することが必要になります。
⑵ 医療用医薬品の添付文書(注意事項等情報)
では、まず、医療用医薬品から見ていきましょう。
① 根拠となる条文
医療用医薬品の添付文書を定めているのは、前述のとおりに薬機法の第52条第1項です。
第52条 (容器等への符号等の記載)
1 医薬品(次項に規定する医薬品を除く。)は、その容器又は被包に、電子情報処理組織を使用する方法その他の情報通信の技術を利用する方法であつて厚生労働省令で定めるものにより、第68条の2第1項の規定により公表された同条第2項に規定する注意事項等情報を入手するために必要な番号、記号その他の符号が記載されていなければならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。
ここには、「医薬品(次項に規定する医薬品を除く。)」とありますが、これは専ら医療用医薬品を指すと考えれば問題ありません。
次に、注意が必要なことは、条文を見ても「添付文書」という言葉がどこにもないことです。その代わりに「注意事項等情報」とされています。これは、従来の「添付文書」という用語が、現在は、「注意事項等情報」の一部として整理されたことによります。
この「注意事項等情報」に関しては、以下の薬機法の第68条の2に定められているのですが、そこでは医薬品、医療機器、再生医療等製品に共通する用語として整理されています。ところが、そこで医薬品に関して定められている内容は、かつて「表示文書」として記載が求められていた内容(旧第52条)と全く同じです。
第68条の2(注意事項等情報の公表)
2 前項の注意事項等情報とは、次の各号に掲げる区分に応じ、それぞれ当該各号に定める事項をいう。
一 医薬品 次のイからホまでに掲げる事項
イ 用法、用量その他使用及び取扱い上の必要な注意
ロ 日本薬局方に収められている医薬品にあつては、日本薬局方において当該医薬品の品質、有効性及び安全性に関連する事項として公表するように定められた事項
ハ 第41条第3項の規定によりその基準が定められた体外診断用医薬品にあつては、その基準において当該体外診断用医薬品の品質、有効性及び安全性に関連する事項として公表するように定められた事項
ニ 第42条第1項の規定によりその基準が定められた医薬品にあつては、その基準において当該医薬品の品質、有効性及び安全性に関連する事項として公表するように定められた事項
ホ イからニまでに掲げるもののほか、厚生労働省令で定める事項
このように見ると分かるように、「添付文書」から「注意事項等情報」へ用語が変わったものの、内容は以前と同じです。
また、電子化に伴い、医療用医薬品に関しては、情報自体が記載されているのではなく、容器または被包に「注意事項等情報を入手するために必要な番号、記号その他の符号」が記載されることになりますが、この「番号、記号その他の符号」というのは「バーコード」のことです。
つまり、利用者は、箱などに記載されたバーコードをスマートフォンなどの端末で読み取ると、PMDAのホームページ上に掲載された最新の添付文書や関連文書(これをまとめて「注意事項等情報」としています)にアクセスでき、そこで情報を確認することになります。
ここで、前回の安全性に関する情報の提供に関してご説明したことを思い出していただきたいのですが、安全性に関する措置がなされる場合、添付文書の改正もなされます。しかし、紙の添付文書の場合、既に市場に流通している医薬品の場合は、改正前の文書が添付されているので、差し替えたり、追加の情報があることを伝える必要があるなどの対応が必要でした。
ところが、これが電子化されたことにより、医師らや使用する者は、常に最新の情報にアクセスできることになります。これは、余計なコストがかからないだけでなく、安全性の確保にとっても非常に有益です。現在、電子化は医療用医薬品に限定されていますが、将来的に、ウェアラブル端末などが一般的になれば、使用する直前に市販薬でも確認できるようになりますので、同様になるのではないかと思います。
なお、以下は、PMDAが医療用医薬品の注意事項等情報へのアクセスをイメージにしたもので、上記の流れがよく分かります。
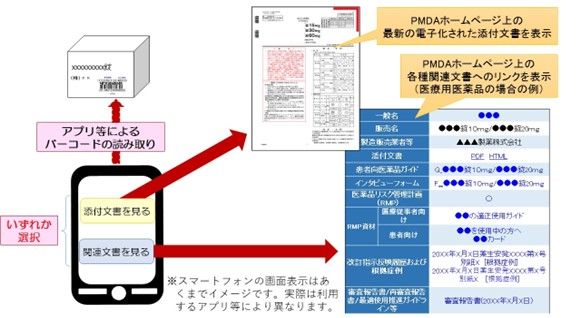
※ 独立行政法人医薬品医療機器総合機構ホームページから引用
② 医療用医薬品の(電子化された)添付文書の内容
次に、電子化された添付文書の記載事項を見ていきます。上記のように、薬機法第68条の2に列記されていますが、実際には「ホ」の事項が大半を占めるため、厚生労働省医薬・生活衛生局安全対策課長の通知「医療用医薬品の添付文書等の記載要領の留意事項について」(平成29年6月8日薬生安発0608第1号)において示されています。
これは、従来の平成9年4月25日の通知に代わるものとして「新記載要領」と呼ばれるものですが、以前のものとの大きな変更点として、医薬品自体の基本情報に関する各項目に「ア~キ」、効能効果や注意事項に関する項目に「1~26」までの分類番号が振られこと、特定の背景を有する患者ごとの注意事項が「9」に整理されたことなどが挙げられます。
◎ 医療用医薬品の新記載要領の記載事項
ア 作成又は改訂年月
イ 日本標準商品分類番号
ウ 承認番号、販売開始年月
エ 貯法、有効期間
オ 薬効分類名
カ 規制区分
キ 名称
1 警告
2 禁忌(次の患者には投与しないこと)
3 組成・性状
3.1 組成
3.2 製剤の性状
4 効能又は効果
5 効能又は効果に関連する注意
6 用法及び用量
7 用法及び用量に関連する注意
8 重要な基本的注意
9 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
9.7 小児等
9.8 高齢者
10 相互作用
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)
11 副作用
11.1 重大な副作用
11.1.1 〇〇
11.2 その他の副作用
12 臨床検査結果に及ぼす影響
13 過量投与
14 適用上の注意
15 その他の注意
15.1 臨床使用に元すく情報
15.2 非臨床試験に基づく情報
16 薬物動態
16.1 血中濃度
16.2 吸収
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.7 薬物相互作用
16.8 その他
17 臨床成績
17.1 有効性及び安全性に関する試験
17.2 製造販売後調査等
17.3 その他
18 薬効薬理
18.1 作用機序
18.2 〇〇作用
19 有効成分に関する理化学的知見
20 取扱い上の注意
21 承認条件
22 包装
23 主要文献
24 文献請求先及び問い合わせ先
25 保険給付上の注意
26 製造販売業者等
上記の各項目の詳細な説明は新記載要領を見ていただければと思いますので、ここではポイントを確認します。
まず、医療用医薬品に関しては、その医薬品に関する多種多様で詳細な情報の記載が義務付けられていること、特に、使用上の注意が必要な点に関しては、様々な観点からの情報が網羅されていることが分かります。これは、言い換えれば、医療用医薬品は、このような注意事項を正確に理解しなければ、患者に使用させることができないということを意味しています。
ここで、医薬品に関する本連載の1回目(第2回)において、医薬品の種類をご説明したことを振り返っていただきたいのですが、その際に「医療用医薬品とは医師が選択するもの」「市販薬は患者や使用する者が自ら選択するもの」とご説明しました。そして、上記の詳細な医薬品情報、特に多種多様な注意事項を把握した上で、患者に最も適切な医薬品を「選択」するためには、医師らの専門知識が不可欠です。
専門知識を踏まえて、個別の患者に向き合っている医師らが医薬品を適切に選択するためには、このような医師らに対して、医薬品に関する正確な情報、注意事項を正確に伝える添付文書の情報は欠かせないものです。その意味でも、最新の情報が迅速に反映される添付文書の電子化は、医療をより安全にするための法改正だといえると思います。
まとめれば、
・医療用医薬品の添付文書は、主に医師らに情報を伝えるためのもの
・電子化されたことで最新の情報にアクセスできるようになった
・記載事項が整理され、より明瞭になった
ことがポイントになります。
⑶ 市販薬の添付文書
では、次に、市販薬の添付文書について見ていきましょう。
① 根拠となる条文
市販薬の添付文書を定めるのは、薬機法第52条の第2項です。
第52条 (容器等への符号等の記載)
2 要指導医薬品、一般用医薬品その他の厚生労働省令で定める医薬品は、これに添付する文書又はその容器若しくは被包に、当該医薬品に関する最新の論文その他により得られた知見に基づき、次に掲げる事項が記載されていなければならない。ただし、厚生労働省令で別段の定めをしたときは、この限りでない。
一 用法、用量その他使用及び取扱い上の必要な注意
二 日本薬局方に収められている医薬品にあつては、日本薬局方において当該医薬品の品質、有効性及び安全性に関連する事項として記載するように定められた事項
三 第41条第3項の規定によりその基準が定められた体外診断用医薬品にあつては、その基準において当該体外診断用医薬品の品質、有効性及び安全性に関連する事項として記載するように定められた事項
四 第42条第1項の規定によりその基準が定められた医薬品にあつては、その基準において当該医薬品の品質、有効性及び安全性に関連する事項として記載するように定められた事項
五 前各号に掲げるもののほか、厚生労働省令で定める事項
この条文を見ていただくと、先ほど医療用医薬品に関して引用した薬機法第68条の2第2項の1号と同内容であることが分かります。つまり、薬機法においては、医療用医薬品も市販薬も、添付文書に記載すべきとされている事項に違いはないことになります。
なお、前述しましたが、市販薬に関しては、使う時点で確認してもらう必要があることと、現在においては、その瞬間にウェブにアクセスして表示させるまでの技術的な段階にないことから、添付文書は、紙に印刷されたものを医薬品に同梱するという従来の方法が継続されています。
② 市販薬の記載事項
市販薬は、安全性や有効性に関する危険性が低いものが指定されますので、医療用医薬品と比較すれば注意事項も多くありません。何よりも、一般用医薬品は、利用する人が任意に選択して購入することのできる医薬品であり、医師らのような専門的知識を前提にするものではありません。そのため、医療用医薬品に比較すると、記載事項も限定されています。
これを詳細に定めているのが厚生労働省医薬食品局長通知「一般用医薬品の添付文書記載要領について」(平成23年10月14日薬食発1014第6号)です。さらに、注意事項に関する細則として、同局長通知「一般用医薬品の使用上の注意記載要領について」(平成23年10月14日薬食発1014第3号)があります。
(なお、補足しますと、上記の2つの通知には、いずれも「一般用医薬品」とあります。すると、「あれ、要指導医薬品はどうなるの?」と疑問を感じる方がいると思いますが、要指導医薬品はこの通知の後の平成25年の薬機法改正によって、従来の一般用医薬品の中で新たに設けられた医薬品区分です。そのため、この通知は現在の要指導医薬品も対象にするものとなります。)
そして、この2つの通知の内容を整理すると、記載事項は以下のようになります。
◎ 一般用医薬品の記載要領の記載事項
1 改訂年月
2 添付文書の必読及び保管に関する事項
3 販売名、薬効名及びリスク区分
4 製品の特徴
5 使用上の注意
・してはいけないこと
(1) 次の人は使用しないこと
(2) 次の部位には使用しないこと
(3) 本剤を使用している間は、次のいずれの医薬品も使用しないこと
(4) その他
・相談すること
(1) 次の人は使用前に医師(歯科医師)、薬剤師(登録販売者)に相談すること
(2) 使用後、次の症状があらわれた場合は副作用の可能性があるので、直ちに使用を中止し、この文書を持って医師、歯科医師、薬剤師又は登録販売者に相談すること
(3) 使用後、次の症状の持続又は増強がみられた場合は、使用を中止し、この文書を持って医師、歯科医師、薬剤師又は登録販売者に相談すること
(4) 一定の期間又は一定の回数を使用しても症状の改善がみられない場合は、使用を中止し、この文書を持って医師、歯科医師、薬剤師又は登録販売者に相談すること
(5) その他
・その他の注意
6 効能又は効果
7 用法及び用量
8 成分及び分量
9 保管及び取扱い上の注意
※ 次のような事項
(1) 温度、湿度、日光等に関する注意
(2) 小児の手の届かない所に保管すべき旨の注意
(3) 他の容器に入れかえることは、事故のもとになったり、品質保持の観点からも好ましくないので、その旨 など
10 消費者相談窓口
11 製造販売業者等の氏名又は名称及び住所
このように見ると、医療用医薬品のように多岐に渡って注意事項が記載されているものではなく、注意事項としては、たった2つ(使う際の注意事項と保管などの取扱いに関する注意事項)しかありません。また、その内容も、誰でも分かるようなやさしい表現の仕方になっています。
市販薬の添付文書のポイントは、
・使用者が一般人であることから注意事項も少なく、分かりやすい表示になっている
・電子化されていないので紙の文書のまま
となります。
⑷ 添付文書のまとめ
以上のように、医療用医薬品と市販薬のそれぞれの添付文書を見てきました。医療用医薬品の添付文書が電子化されたとはいえ、薬機法の定めは全く同内容であることもご説明しました。
しかし、実際には、いずれも「医薬品の説明書」という点では同様の制度であっても、誰がその説明書を見るのかという違いを踏まえ、実際の記載事項やその仕方は大きく異なっています。医療用医薬品の添付文書は専門的かつ広範囲で詳細なものですが、市販薬の添付文書は優しく読みやすいものになっています。
薬機法の条文は一見固く、読解も優しいものではありませんが、これに基づく制度は、実情に合わせたきめ細やかなものになっていることがよく分かると思います。
⑸ 外部の容器(外箱など)の表示
なお、最後に、市販薬の外部の容器・被包の表示に関してご説明します。
これは、「添付文書」というよりは、初めにご説明した「医薬品の表示」を補足するものなのですが、市販薬の添付文書に近いものと理解したほうが分かりやすいかと思います。
まず、皆さんがドラッグストアで医薬品を手に取ると、箱の裏面などに注意事項などが記載されていることに気付くと思います。これが「外部の容器・被包の表示」と呼ばれるものになります。「直接の容器・被包」ではなく、「外部の容器・被包」への記載です。
この表示の根拠は、薬機法の第51条です。
第51条
医薬品の直接の容器又は直接の被包が小売のために包装されている場合において、その直接の容器又は直接の被包に記載された第44条第1項若しくは第2項又は前条各号に規定する事項が外部の容器又は外部の被包を透かして容易に見ることができないときは、その外部の容器又は外部の被包にも、同様の事項が記載されていなければならない。
ここには「小売りのために」とありますので、主に一般用医薬品を対象にしていることが分かります。また、記載事項も、第44条と第50条(=「前条各号」)とあるため、表示事項で定められているものと同じ項目になります。
そして、直接の容器や被包に記載されたものを透かして見ることができないときは、それに加えて、さらに、記載することを求めているものになります。もっとも、ドラッグストアで手に取る医薬品の多くは、保存や管理の関係で透明ではない箱に入っていますので、「透かして見ること」はできません。そのため、大半の市販薬は、直接の容器や被包への表示に加え、外箱への表示も必要になっています。
なお、このように見ると、「やっぱり直接の容器や被包への表示と同じじゃないか」と思われるかもしれませんが、ポイントは、薬機法の第52条第2項に関わります。この第52条の第2項は、先ほど見たように市販薬の添付文書に関する規定なのですが、表示のところで見たように、直接の容器や被包への表示が必要なものともされています。しかし、「添付文書又はその容器若しくは被包に」とあるので、添付文書に記載すれば、容器や被包には表示しなくてもよいことになり、実際上も、注意事項などは直接の容器や被包には記載されていません。
ところが、外箱への表示に関しては、市販薬の添付文書に関する注意事項の記載方法を定めた通知において、使用上や取扱い上の注意事項などを記載するように求めていますので、表示が必要になるのです。そして、この通知では、添付文書の記載例に準じて記載するとされていますので、実際には、表示よりは、添付文書に近いものになっています。
特に使用上の注意事項は、使用するまさにその時に伝達したい事項であるにもかかわらず、スペースの問題から表示ができないため、外箱に記載して伝えるようにしているのです。
5.医薬品などの広告
⑴ 薬機法による広告規制の概要
医薬品に関する情報のうち、もっとも広範囲な人に伝えられるのは、広告を通してのものになるかと思います。
医薬品は、病気に苦しむ人のために、長い時間の研究や試験を重ねて開発され、ようやく届けられる製品です。開発に携わる企業にとっては、多くのコストをかけていますし、次の医薬品を開発するためにも、多くの人に買ってもらおうとすることは当然のことだと思いますし、そのためには、広告を通じて製品をアピールすることが不可欠になります。
もっとも、そこで誤った情報を伝えたり、問題のある広告をしてしまうと、購入する人の健康にも悪影響を与えてしまう可能性が高く、ほかの「モノ」との違いもそこにあります。
そのため、医薬品などに関しては、非常に厳しい広告ルールが定められています。
そこで、医薬品の解説の最後として、医薬品などの広告に関するルールの概要をご説明します。
※ ここで「概要」としたのは、医薬品の広告に関する規制を詳細に見ていくと、それだけで1冊の本になる程度の文量が必要になるためです。
そのため、ここでは、薬機法の条文を中心に、薬機法による広告規制の全体像だけ確認したいと思います。
⑵ 広告規制に関連する条文、適正広告基準と解説
医薬品などに関する広告規制については、数年前に代理店を含めて複数の人が逮捕される事件が起き、また、新たに課徴金制度が設けられたこともあって、世間的には注目を集めています。
もっとも、あまり知られていないことですが、薬機法の「第10章 医薬品等の広告」のなかの条文を見ると、規制される広告の内容を定める条文は、以下のようにわずか3つの条文しかありません。
◎ 薬機法における広告規制の条文
第66条
第1項 虚偽・誇大広告の禁止
第2項 医師その他の者による効能効果、性能に関する保証表現の禁止
第3項 堕胎を暗示する広告及びわいせつな広告の禁止
第67条 特定疾病用の医薬品・再生医療等製品の一般人への広告の禁止
第68条 未承認医薬品等の広告の禁止
しかし、実は、第66条第1項の虚偽・誇大広告の禁止に関しては、「別の基準」により、詳細にルールが定められています。それが「医薬品等適正広告基準」です。
これは、1949年に当時の厚生省薬務局長が定めた「医薬品適正広告基準」がベースとなり、その後、対象に医薬部外品、化粧品、医療機器、再生医療等製品が追加されていったもので、直近では平成29年(2017年)9月29日に改正されています。
適正広告基準では、その「第1」で、この基準の目的が「広告が虚偽、誇大にわたらないようにするとともにその適正を図ること」をされ、薬機法第66条第1項が遵守されるようにすることと、その内容を適正にするためのものであることが明確に謳われています。
その内容を説明することは別の機会にしますが、その対象範囲は以下のとおりであり、医薬品などの広告全般に亘って、詳細に定められていることが分かります。
◎ 適正広告基準が「基準」として定める項目
医薬品の名称、製造方法、効能効果・性能・安全性、
過剰消費・乱用助長の防止、医療用医薬品に関する事項、
特定疾患用の医薬品に関する事項、習慣性医薬品に関する事項、
使用上の注意等に関する事項、他社の製品の誹謗広告、医薬関係者等の推薦、
懸賞・賞品等に関する事項、不快、迷惑等に関する広告の事項、
テレビ等の提供番組等に関する事項、化粧品的用法等に関する事項
なお、適正広告基準に関しては、基準の内容をさらに説明するものとして、厚生労働省医薬・生活衛生局監視指導・麻薬対策課長の通知「医薬品等適正広告基準の解説及び留意事項等について」(平成29年5月29日 薬生監麻発0929第5号)があり、ここで基準の解釈などが詳細に解説されています。
このように、薬機法の条文自体は非常にシンプルなものに見えますが、医薬品の広告規制は、適正広告基準とその解説により詳細かつ多くのルールが設けられており、これらは、薬機法第66条第1項の内容を具体化し、また、公式な解釈を示すものとなりますので、広告をするにあたっては、それらの内容を正確に理解することが必要になります。
⑶ 業界の自主基準
さらに、これらの基準のほか、国の定める基準ではありませんが、医薬品の業界団体である日本一般用医薬品連合会が、業界の自主基準として「OTC医薬品等の適正広告ガイドライン」(最新版は2019年度版)を策定しており、会員企業への遵守を求めています。
この内容は、適正広告基準に準拠した上で、OTC医薬品(市販薬)に関連する条項を整理した上で分かりやすい解説を加えており、さらに、適正広告基準には定められていないルールを多数設定しています。業界の自主基準という位置付けにはなりますが、事実上、厚生労働省の確認の上で策定されているものであり、ここで設けられたルールも、薬機法の内容の解釈を示すものとして法規範に準ずるものと考えて、遵守すべきものだと思います。
⑷ 課徴金制度
以上が、広告に関するルールの概要になりますが、この規制を実効的なものとするために、令和3年に施行された課徴金制度があります。
こちらの詳細に関しては、以前にご説明しておりますので、ご参照いただければと思います。
【弁護士解説】薬機法改正―広告規制違反に対する課徴金制度の導入
ここでは、そのポイントをご説明しますと、課徴金制度とは、
①「課徴金対象行為」をした場合、
②「課徴金対象期間」に行った取引の
③「課徴金対象行為に係る医薬品等の対価合計額」に4.5%を乗じて得た額を納付することを命じられる
とするものです。
この①の「課徴金対象行為」というのが、要するに違反広告になりますが、薬機法第66条第1項の「医薬品、医療機器等の名称、製造方法、効能、効果又は性能に関する虚偽・誇大広告」に限定されています。つまり、同項以外の違反に対しては課徴金の対象になりません。
しかし、広告規制の内容の詳細は適正広告基準が定めており、その基準の対象は主に第66条第1項に関するものになりますので、事実上は「ほとんどの違反広告が対象になる」と考えるのが適切だと思います。
本日時点においては、この制度による課徴金が科された事例は確認できていませんが、私見として、インターネット広告を中心に違反広告がかなり見受けられるように思われますので、近い時期に事例が発生してもおかしくないように感じています。
⑸ 医薬品などの広告のまとめ
以上、医薬品等の広告に関しては、薬機法の条文だけでなく、適正広告基準や業界の自主基準により、巨大な森のような広範なルールが定められています。また、実効性を高めるために厳しい課徴金制度が設けられたほか、私が対応している業務においても、証券取引所の上場審査やM&Aのためのデューディリジェンスにおいても、違反広告が生じないようにするための社内体制があるかどうかを問われるケースが急増しています。
広範な広告規制のルールを正確に理解した上で、消費者に対して製品をアピールすることが求められています。
6.まとめ
以上、今回は、消費者に医薬品の情報を伝える場面として、医薬品の表示、添付文書、そして広告に関してご説明しました。
今回も、多くの内容になりましたが、医薬品に関する情報が消費者の生命や健康にダイレクトに結びつくものであるという意識を持つことで、適切に対処できることばかりだと思います。
・医薬品直接のの容器や被包への表示は、使う直前に伝えるべき情報の記載
使う人の目線に立って、表示される情報の意味を理解することが大切
・医療用医薬品の添付文書は電子化されたが、市販薬に関しては現状通り
記載内容に違いはあるが、「誰が読むための情報なのか?」を意識して整理するのがポイント
・医薬品等の広告ルールは詳細かつ膨大
規制も厳しくなっているので、しっかりとした対応が必要になる
7.医薬品に関する制度の振り返りと視点
これまで全6回に亘り、医薬品に関する薬機法の制度をご説明してきました。
医薬品に関する連載の最後に、少し振り返ってみましょう。
まず、皆さんにとって身近な「医薬品を購入する」という場面から始め、医薬品の販売に関する制度を見ました。そこでは、医薬品には様々な種類があること、その種類によって販売制度が変わることを確認しました。
次に、その医薬品を製造し、市場に流通させるために必要な制度を見てきました。そこでは、医薬品を市場に流通させる者、医薬品を製造する者に対する許可の制度と、医薬品自体に対する薬事承認の制度を見ました。
その後、市場に流通した医薬品の品質、安全性、有効性に関して、常にチェックが必要になることと、そのための制度を確認しました。
そして、今回は、最後に、消費者に対して医薬品の情報が表示される場面での各制度を見てまいりました。
この、製造販売・製造、販売、製造販売後の管理、消費者への表示という視点は、薬機法が規制する他の「モノ」、つまり、医薬部外品、化粧品、医療機器、再生医療等製品に関する諸制度とも共通するものです。
次回からは、医薬部外品などの他の「モノ」に関する説明になりますが、薬機法は、そもそも医療や美容という「人の生命や身体に関して使用されるモノ、道具に関する法律」です。
皆さんは、医薬品で理解した視点をもとに、「他の「モノ」はどこが医薬品とは異なるのか」という意識で見ていただくと、薬機法の理解がより深まると思います。
なお、次回は、もともとは医薬品として扱われながら、別のものとして分類される「医薬部外品」に関してご説明します。